對增材製造技術與骨缺損替代物材料的探討與思考
臨床統計顯示,有5%~10%的骨折會導致無法自愈的嚴重骨缺損。修復此類缺損的金標準是自體骨移植物,然而,這種解決方法並不理想:取自體骨需要二次或多次手術,骨量有限,供區也有感染、疼痛等風險。而通過增材製造技術製成的3D列印支架,其多孔結構設計可允許血液流通和骨組織長入,其工藝參數的調整可一定程度上複製骨的各向異性,通過斷層掃描技術或磁共振成像技術獲取的骨缺損精確3D圖像,也可製造出貼合患者骨缺損形狀的骨植入物。
在過去的幾年裏,增材製造技術已成為生物醫學研究領域,尤其是骨組織再生領域的一項新興技術。在增材製造技術出現之前,傳統技術(如溶膠-凝膠法、氣體發泡法或冷凍乾燥法等)也可實現骨支架材料的多孔設計,但這些技術無法保證3D支架結構的可重復性。而穩定可控且連通性高的多孔結構,正是實現細胞遷移、粘附和增殖的重要因素。通過這項技術,可將比對患者骨缺損形狀-調整植入物形狀的步驟挪至術前,從而大大減少醫生在術中調整植入物的手術時間,進而降低了手術風險。因此,增材製造技術適合應用於個性化醫療之中,尤其是創傷或腫瘤切除引起的形狀非常複雜的骨缺損情形。
在通過增材製造技術進行患者個性化骨缺損替代物設計之前,首先要選擇合適的材料作為“基石”。一般來説,在骨組織工程中選擇材料需要考慮六個重要標準:倣生,即盡可能模擬天然骨特性,同時應具有良好的生物相容性;機械性能,即彈性模量和壓縮剛度應足以支援骨骼生長,但也不會過高導致出現應力遮罩的情況;長期生物降解性,在理想情況下,支架應逐漸被新生骨取代;易於成像,一般通過骨與支架材料之間的對比度實現,這有利於術後跟蹤定位和觀察骨長入效果;如需要,應能較為容易地切割組織切片;無菌,且滅菌過程不影響支架材料的功能。其中,第五個標準主要應用於臨床前研究中,通過組織切片觀察,可評估新生成的骨組織品質、成熟度、類型、排異反應、新血管的形成以及周邊組織和支架的相互作用(即是否與支架表面接觸,是否滲入孔隙等);第六個標準雖然經常被忽視,但其實對於多孔設計來説,滅菌過程至關重要。
從材料類型來説,目前可用作骨缺損替代物的材料大致分為四種:聚合物、陶瓷、聚合物與陶瓷複合材料、金屬。下表介紹了以上四種材料在前述六個重要標準下各自的特點。
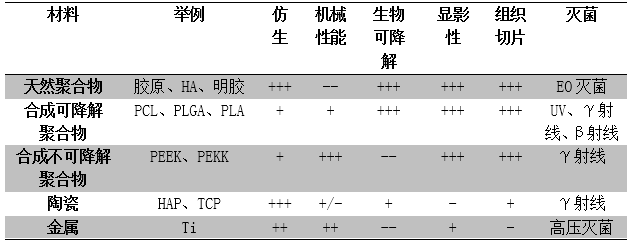
表 根據六項標準對材料性能進行分析
【注:從--(非常差)到+++(優異的性能)排列】
聚合物
天然聚合物
聚合物可分為天然聚合物和合成聚合物。天然聚合物,如殼聚糖、膠原蛋白、透明質酸、明膠或絲素蛋白等,均具有優異的生物相容性和生物降解性。它們的降解週期通常在2~24周,且不會産生任何酸性副産物。但由於它們的機械性能較弱,無法承受施加在骨骼上的力,因此這些材料主要作為添加劑或複合材料的一部分使用,發揮其骨誘導特性以及增強細胞核蛋白質粘附的能力。這種材料通常使用相對低溫且溫和的環氧乙烷滅菌,而不建議選擇電子束輻照或高壓滅菌。電子束輻照會加速聚合物的降解速率,增加材料的化學交聯,高壓滅菌則會降低材料的粘度和機械強度。
合成可降解聚合物
合成可降解聚合物通常包括PCL、PLGA、PLA、PPF等,它們的降解速率可調節,通常超過一年或兩年,同時也兼具良好的生物相容性和骨傳導性。與天然骨的抗壓強度(2~12MPa)和壓縮模量(52~318MPa)相比,它們具有良好的機械性能,抗壓強度約為2~39MPa(取決於孔隙率),同時其可透射線、較輕的重量和組織相容性都有利於臨床前研究,但材料本身沒有誘導骨形成的功能。對於該種材料,應避免高壓滅菌、環氧乙烷滅菌和電漿滅菌,建議採用紫外線照射、γ射線或β射線輻照滅菌。
合成不可降解聚合物
不可降解聚合物,如PEEK、PEKK等,根據孔隙率的不同,壓縮模量範圍約為0.14~8.21GPa,抗壓強度約為25~200MPa。與其他聚合物類似,它們也可透射線,同時具有生物相容性。然而,這類材料與細胞或生長因子的相互作用差且骨整合率低(即支架與宿主骨的整合差),因此也有表面噴塗鈦或羥基磷灰石涂層以達成表面改性、改善骨整合的目的。一般來説,不可降解聚合物可應用的主要滅菌技術是γ射線輻照滅菌,因為高壓滅菌可能會引起材料物理化學性質的變化。需注意這類材料不可降解,通過手術去除材料對於患者是一個額外的侵入性風險。
陶瓷
陶瓷是一種被廣泛研究的骨缺損替代材料,與天然骨無機相成分相似,具備出色的倣生性——同時具有骨傳導性和骨誘導性。在骨組織工程中,應用最廣泛的陶瓷是磷酸鈣,即羥基磷灰石(HA)和磷酸三鈣(TCP),它們的均可被生物降解,但降解速率有所不同。陶瓷的抗壓強度範圍為3~18MPa,相對較弱,不太適合承重。由於成分和密度與原生骨相似,陶瓷在影像上不易與原生骨區分,這也使得組織學分析變得複雜。通常來説,陶瓷可用於修復各種缺陷,也可作為支架填料或涂層以增強支架的生物活性。γ射線滅菌一般是陶瓷的最佳滅菌工藝。
聚合物與陶瓷複合材料
為了優化骨缺損替代物的機械和生物學特性,聚合物與陶瓷複合材料應運而生,其中最廣泛使用的複合材料為PCL/β-磷酸三鈣(β-TCP)。
PCL的降解速率非常慢,因此,添加β-TCP可實現更高的降解速率、更好的壓縮性能及更強的骨誘導性。
金屬
骨組織工程中應用最廣泛的金屬是鈦及鈦合金以及不銹鋼,均為不可降解金屬。這類材料具有良好的生物相容性,其機械性能與天然骨骼接近或偏高(壓縮模量約為5~35GPa,抗壓強度約為50~325MPa)。需要注意的是,在臨床使用過程中,較高的彈性模量可能會産生應力遮罩;磨損或腐蝕過程中釋放的金屬離子也可能導致組織吸收或壞死;其較高的硬度也不利於臨床前組織切片研究。
骨缺損,尤其是臨界尺寸骨缺損的治療仍具有挑戰性。為滿足臨床需求,骨替代植入物應具備以下特徵:生物相容性良好,最好是生物可降解材料;具備可讓細胞和體液滲透的多孔結構,但同時擁有足以抵抗生理負荷的機械強度;匹配骨缺損部位的形狀;易於加工;醫生容易操作。
增材製造技術提供了提供定制骨缺損替代支架的可能性,該支架具有完美適應給定缺陷的外部形狀和利於骨修復的內部結構。將增材製造技術與適合的材料相結合,可有效控制骨缺損替代物等機械和生物學特性。
(作者:李錚 作者單位:國家藥監局醫療器械技術審評中心)
掃碼關注中國福建微信

掃一掃在手機上查看當前頁面



 閩政通APP
閩政通APP


 閩公網安備:35000899002
閩公網安備:35000899002 


